교육신청
- 전체
- PI,Sub-I
- IRB(의사)
- IRB(의사 외)
- CRP
- CRA
- CRC
- QA
- GCP
- 공통
- 중개임상
- 임상시험설계
- PM
- 규제과학,인허가
- DM
- 통계
- MW
- PV
- 기초의학이론
- 임상시험 품질관리
- 대학연계프로그램
- KIC
[CRC > 신규]
[온라인] 2022년 임상시험코디네이터(CRC) 신규자 과정
임상시험종사자 직능(식약처 기준)
코디네이터(CRC)신규자
소개
목차
교육일정
학습개요
1. 수료조건: 온라인 진도율 100% + 시험 60점 이상 + 교육만족도 설문조사(필수)
2. 교육대상: 식약처 기준 임상시험코디네이터(CRC) 신규자 교육 대상자
3. 교육신청 및 수강가능 기간: 2022년 5월 11일(수) 10:00 ~ 2022년 12월 31일(토) 24:00
(교육 신청일로부터 한달(30일) 이내 수강 가능합니다. 기한에 유의해주시기 바랍니다.)
4. 본 교육은 임상시험 코디네이터 업무 경력이 없는 사람이 이수한 경우,
식약처 기준 임상시험코디네이터(CRC) 신규자 교육 20시간으로 인정되는 교육입니다.
* 본 교육과정은 지난 2022년 3월 2일(수)~3월 4일(금) 시행했던 교육과정과 동일한 과정입니다.
* 본 교육과정의 교육자료는 표준교재(PDF) 및 실습자료(PDF)가 제공됩니다.
(임상교육원 홈페이지(https://lms.konect.or.kr) → 교육 신청 → 마이페이지 → 공지사항 → 다운로드)
* 실습자료(PDF)는 '임상시험 계획서(자료집, 매뉴얼IP, IB 포함)의 이해 및 검토', '시험대상자 모집/선정 과정의 이해' 교육 수강시 활용하시기 바랍니다.
※ GCP 교육이 필요한 경우 [GCP 신규자 교육]을 별도 이수하시기 바랍니다.
GCP 신규자 교육 신청 바로가기▶ 임상교육원 (konect.or.kr)
커리큘럼
종사자별 연간이수시간
[별표 1]
임상시험 종사자별 교육과정 및 연간이수시간
(제5조 관련)
1. 교육과정 및 연간이수시간
교육과정 | 해당 분야 실시경험이 없는 종사자 | 해당 분야 실시경험이 있는 종사자2) | ||
신규자 교육과정 (우선교육시간)1) | 심화 교육과정 | 보수 교육과정 | ||
가. 임상시험 시험책임자3)또는 그에 준하는 자4) | 8시간 이상 (4시간 이상) | 6시간 이상 | 4시간 이상 | |
나. 심사위원회 위원 | 의사등3) | 8시간 이상 (4시간 이상) | 6시간 이상 | 4시간 이상 |
그 밖의 위원 | 12시간 이상 (6시간 이상) | 6시간 이상 | 4시간 이상 | |
다. 관리약사 | 8시간 이상 (4시간 이상) | 6시간 이상 | 4시간 이상 | |
라. 임상시험 모니터요원 | 40시간 이상 (20시간 이상) | 24시간 이상 | 8시간 이상 | |
마. 임상시험 코디네이터 | ||||
바. 임상시험 실시기관 품질보증 담당자 | ||||
1) 규칙 제38조의2제3항 후단 및 제5조제2항에 따라 임상시험 업무 경력이 없는 사람이 그 업무를 시작하기 전에 받아야 하는 교육시간을 말한다. 2) 심화 또는 보수 교육과정의 교육대상자이면서 교육을 실시한 경우에는 교육시간을 이수시간으로 인정하며, 심포지엄, 워크숍, 세미나, 실무실습 등으로 이수할 수 있다. 보수과정은 평가를 생략할 수 있다. 3) 의사 등이 시험책임자ㆍ시험담당자 교육과정에서 이수 받은 교육시간은 심사위원회 교육과정에서 이수 받은 교육시간으로 보며, 반대의 경우도 동일하게 적용한다. 4) 시험책임자의 위임 및 감독 하에 임상시험과 관련된 업무를 담당하거나 필요한 사항을 결정하는 의사ㆍ치과의사ㆍ한의사를 말한다.
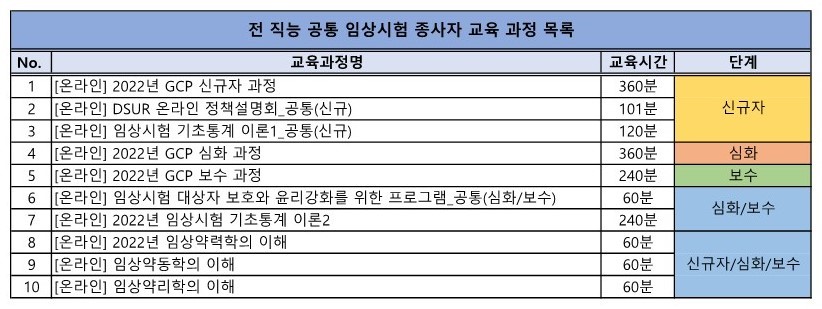
※ 전 직능 공통으로 인정되는 임상시험 종사자 교육 목록 *단계는 맞게 들으셔야 합니다.
| ||||
수료/과락 기준
| 평가기준 | 집합 출석율 | 온라인 진도율 | 시험 | 과제 | 토론 | 기타 |
|---|---|---|---|---|---|---|
| 배점비율 | - | 90.00% | 10.00% | - | - | - |
| 과락기준 | - | 100% | 60점 | - | - | - |
목차
| No | 구분 | 강의명 | 학습기간 | 시간 |
|---|---|---|---|---|
| 1 | 온라인/강의 | 1-1. 임상시험 절차의 개요 | 상시 | 30분 |
| 2 | 온라인/강의 | 1-2. 임상시험 실시 단계별 업무 1 | 상시 | 42분 |
| 3 | 온라인/강의 | 1-3. 임상시험 실시 단계별 업무 2 | 상시 | 52분 |
| 4 | 온라인/강의 | 1-4. 임상시험 관련자의 정의 및 역할 1 | 상시 | 34분 |
| 5 | 온라인/강의 | 1-5. 임상시험 관련자의 정의 및 역할 2 | 상시 | 18분 |
| 6 | 온라인/강의 | 1-6. 임상시험 관련자의 정의 및 역할 3 | 상시 | 22분 |
| 7 | 온라인/강의 | 2-1. 임상시험 계획서의 정의 및 관련 규정 | 상시 | 22분 |
| 8 | 온라인/강의 | 2-2. 임상시험 계획서의 구성 항목 및 주요 검토 사항 | 상시 | 34분 |
| 9 | 온라인/강의 | 2-3. 임상시험 계획서 실습 1 | 상시 | 41분 |
| 10 | 온라인/강의 | 2-4. 임상시험 계획서 실습 2 | 상시 | 25분 |
| 11 | 온라인/강의 | 3-1. 시험대상자 선정 과정 및 시험대상자 모집 시 고려사항 | 상시 | 26분 |
| 12 | 온라인/강의 | 3-2. 시험대상자 모집 관련 규정 및 모집문 요건 | 상시 | 33분 |
| 13 | 온라인/강의 | 3-3. 시험대상자 모집문의 요건 및 모집 방법의 예시 | 상시 | 41분 |
| 14 | 온라인/강의 | 3-4. 시험대상자 모집/선정 과정의 이해 실습 | 상시 | 19분 |
| 15 | 온라인/강의 | 4-1. 증례기록서의 개요 | 상시 | 36분 |
| 16 | 온라인/강의 | 4-2. 워크시트의 개념/종류/개발 과정 | 상시 | 26분 |
| 17 | 온라인/강의 | 4-3. 증례기록서 작성 | 상시 | 20분 |
| 18 | 온라인/강의 | 4-4. 질의문(쿼리) 종류 및 해결 방법 | 상시 | 21분 |
| 19 | 온라인/강의 | 5-1. 임상시험에서의 문서 개념 및 구성, 임상시험 문서 관련 규정 1 | 상시 | 38분 |
| 20 | 온라인/강의 | 5-2. 임상시험 문서 관련 규정 2 | 상시 | 38분 |
| 21 | 온라인/강의 | 5-3. 근거 자료 수집 및 작성 방법의 이해 | 상시 | 20분 |
| 22 | 온라인/강의 | 5-4. 문서관리 시 주의사항 및 지적사항, 문서 보관 방법 | 상시 | 25분 |
| 23 | 온라인/강의 | 6-1. 임상시험용 의약품 관리 1 | 상시 | 29분 |
| 24 | 온라인/강의 | 6-2. 임상시험용 의약품 관리 2 | 상시 | 24분 |
| 25 | 온라인/강의 | 7-1. 임상시험 관련 검체 관리 | 상시 | 39분 |
| 26 | 온라인/강의 | 7-2. 임상시험 검사 관리 | 상시 | 20분 |
| 27 | 온라인/강의 | 8-1. Informed Consent 개념의 도입 배경, 임상시험 동의서 관련 규정 | 상시 | 33분 |
| 28 | 온라인/강의 | 8-2. 임상시험 동의 절차 | 상시 | 25분 |
| 29 | 온라인/강의 | 8-3. 시험대상자 상황별 동의 취득 시 주의사항 | 상시 | 41분 |
| 30 | 온라인/강의 | 8-4. 시험대상자 관리 방법 1 | 상시 | 43분 |
| 31 | 온라인/강의 | 8-5. 시험대상자 관리 방법 2 | 상시 | 27분 |
| 32 | 온라인/강의 | 8-6. 시험대상자 동의 및 관리 실습 1 | 상시 | 11분 |
| 33 | 온라인/강의 | 8-7. 시험대상자 동의 및 관리 실습 2 | 상시 | 17분 |
| 34 | 온라인/강의 | 9-1. 이상반응의 정의 | 상시 | 32분 |
| 35 | 온라인/강의 | 9-2. 이상반응의 평가 1 | 상시 | 26분 |
| 36 | 온라인/강의 | 9-3. 이상반응의 평가 2 | 상시 | 28분 |
| 37 | 온라인/강의 | 9-4. 이상반응 보고 | 상시 | 22분 |
| 38 | 온라인/강의 | 10-1. 품질 및 모니터링 | 상시 | 32분 |
| 39 | 온라인/강의 | 10-2. 점검 및 실태조사 | 상시 | 29분 |
| 40 | 온라인/시험 | [온라인] 2022년 임상시험코디네이터(CRC) 신규자 과정_TEST | ~ 1900-01-01 00:00 | 1시간 |
| 41 | 온라인/설문 | [온라인] 2022년 임상시험코디네이터(CRC) 신규자 과정_설문 | ~ 1900-01-01 00:00 | - |
교육일정
| 날짜 | 시간 | 강의제목 |
|---|---|---|
| 상시 | 상시 | 1-1. 임상시험 절차의 개요 |
| 상시 | 상시 | 1-2. 임상시험 실시 단계별 업무 1 |
| 상시 | 상시 | 1-3. 임상시험 실시 단계별 업무 2 |
| 상시 | 상시 | 1-4. 임상시험 관련자의 정의 및 역할 1 |
| 상시 | 상시 | 1-5. 임상시험 관련자의 정의 및 역할 2 |
| 상시 | 상시 | 1-6. 임상시험 관련자의 정의 및 역할 3 |
| 상시 | 상시 | 2-1. 임상시험 계획서의 정의 및 관련 규정 |
| 상시 | 상시 | 2-2. 임상시험 계획서의 구성 항목 및 주요 검토 사항 |
| 상시 | 상시 | 2-3. 임상시험 계획서 실습 1 |
| 상시 | 상시 | 2-4. 임상시험 계획서 실습 2 |
| 상시 | 상시 | 3-1. 시험대상자 선정 과정 및 시험대상자 모집 시 고려사항 |
| 상시 | 상시 | 3-2. 시험대상자 모집 관련 규정 및 모집문 요건 |
| 상시 | 상시 | 3-3. 시험대상자 모집문의 요건 및 모집 방법의 예시 |
| 상시 | 상시 | 3-4. 시험대상자 모집/선정 과정의 이해 실습 |
| 상시 | 상시 | 4-1. 증례기록서의 개요 |
| 상시 | 상시 | 4-2. 워크시트의 개념/종류/개발 과정 |
| 상시 | 상시 | 4-3. 증례기록서 작성 |
| 상시 | 상시 | 4-4. 질의문(쿼리) 종류 및 해결 방법 |
| 상시 | 상시 | 5-1. 임상시험에서의 문서 개념 및 구성, 임상시험 문서 관련 규정 1 |
| 상시 | 상시 | 5-2. 임상시험 문서 관련 규정 2 |
| 상시 | 상시 | 5-3. 근거 자료 수집 및 작성 방법의 이해 |
| 상시 | 상시 | 5-4. 문서관리 시 주의사항 및 지적사항, 문서 보관 방법 |
| 상시 | 상시 | 6-1. 임상시험용 의약품 관리 1 |
| 상시 | 상시 | 6-2. 임상시험용 의약품 관리 2 |
| 상시 | 상시 | 7-1. 임상시험 관련 검체 관리 |
| 상시 | 상시 | 7-2. 임상시험 검사 관리 |
| 상시 | 상시 | 8-1. Informed Consent 개념의 도입 배경, 임상시험 동의서 관련 규정 |
| 상시 | 상시 | 8-2. 임상시험 동의 절차 |
| 상시 | 상시 | 8-3. 시험대상자 상황별 동의 취득 시 주의 사항 |
| 상시 | 상시 | 8-4. 시험대상자 관리 방법 1 |
| 상시 | 상시 | 8-5. 시험대상자 관리 방법 2 |
| 상시 | 상시 | 8-6. 시험대상자 동의 및 관리 실습 1 |
| 상시 | 상시 | 8-7. 시험대상자 동의 및 관리 실습 2 |
| 상시 | 상시 | 9-1. 이상반응의 정의 |
| 상시 | 상시 | 9-2. 이상반응의 평가 1 |
| 상시 | 상시 | 9-3. 이상반응의 평가 2 |
| 상시 | 상시 | 9-4. 이상반응 보고 |
| 상시 | 상시 | 10-1. 품질 및 모니터링 |
| 상시 | 상시 | 10-2. 점검 및 실태조사 |